Нозокомијална пнеумонија је најчешћа и озбиљна нозокомијална инфекција, од којих вентилатор-асоцирана пнеумонија (ВАП) чини 40%. ВАП узрокована рефракторним патогенима је и даље тежак клинички проблем. Годинама су смернице препоручивале низ интервенција (као што су циљана седација, подизање главе) како би се спречила ВАП, али ВАП се јавља код чак 40% пацијената са трахеалном интубацијом, што резултира дужим боравком у болници, повећаном употребом антибиотика и смрћу. Људи увек траже ефикасније превентивне мере.
Вентилаторно-асоцирана пнеумонија (ВАП) је нови облик пнеумоније која се развија 48 сати након трахеалне интубације и представља најчешћу и најсмртоноснију нозокомијалну инфекцију на одељењу интензивне неге (ЈИБ). Смернице Америчког друштва за инфективне болести из 2016. године разликују ВАП од дефиниције болнички стечене пнеумоније (ХАП) (ХАП се односи само на пнеумонију која се јавља након хоспитализације без трахеалне цеви и није повезана са механичком вентилацијом; ВАП је пнеумонија након трахеалне интубације и механичке вентилације), а Европско друштво и Кина сматрају да је ВАП и даље посебан тип ХАП [1-3].
Код пацијената на механичкој вентилацији, инциденца вентилационо-акутне инфекција (ВАП) креће се од 9% до 27%, стопа смртности се процењује на 13%, и може довести до повећане системске употребе антибиотика, продужене механичке вентилације, продуженог боравка на интензивној нези и повећаних трошкова [4-6]. ХАП/ВАП код пацијената без имунодефицијенције обично је узрокован бактеријском инфекцијом, а дистрибуција уобичајених патогена и њихове карактеристике отпорности варирају у зависности од региона, болничке класе, популације пацијената и изложености антибиотицима, и мењају се током времена. Pseudomonas aeruginosa је доминирала међу патогенима повезаним са ВАП-ом у Европи и Америци, док је више Acinetobacter baumannii изоловано у терцијарним болницама у Кини. Једна трећина до једна половина свих смртних случајева повезаних са ВАП-ом директно је узрокована инфекцијом, при чему је стопа смртности случајева изазваних Pseudomonas aeruginosa и acinetobacter-ом већа [7,8].
Због јаке хетерогености вентилационо-аурикуларне инфекција (ВАП), дијагностичка специфичност његових клиничких манифестација, снимања и лабораторијских тестова је ниска, а распон диференцијалне дијагнозе је широк, што отежава благовремену дијагнозу ВАП-а. Истовремено, бактеријска резистенција представља озбиљан изазов за лечење ВАП-а. Процењује се да је ризик од развоја ВАП-а 3%/дан током првих 5 дана коришћења механичке вентилације, 2%/дан између 5 и 10 дана и 1%/дан током остатка времена. Врхунска инциденца се генерално јавља након 7 дана вентилације, тако да постоји временски оквир у којем се инфекција може рано спречити [9,10]. Многе студије су се бавиле превенцијом ВАП-а, али упркос деценијама истраживања и покушаја да се ВАП спречи (као што је избегавање интубације, спречавање поновне интубације, смањење седације, подизање главе кревета за 30° до 45° и орална нега), чини се да се инциденца није смањила, а повезано медицинско оптерећење остаје веома високо.
Инхалациони антибиотици се користе за лечење хроничних инфекција дисајних путева од 1940-их. Пошто могу максимизирати испоруку лекова до циљног места инфекције (тј. дисајних путева) и смањити системске нежељене ефекте, показали су добру вредност примене код разних болести. Инхалациони антибиотици су сада одобрени од стране Америчке агенције за храну и лекове (FDA) и Европске агенције за лекове (EMA) за употребу код цистичне фиброзе. Инхалациони антибиотици могу значајно смањити бактеријско оптерећење и учесталост егзацербација бронхиектазије без повећања укупних нежељених догађаја, а тренутне смернице су их препознале као терапију прве линије за пацијенте са инфекцијом Pseudomonas aeruginosa и честим егзацербацијама; Инхалациони антибиотици током периоперативног периода трансплантације плућа могу се користити и као адјувантни или профилактички лекови [11,12]. Али у америчким смерницама за VAP из 2016. године, стручњаци нису имали поверења у ефикасност адјувантних инхалационих антибиотика због недостатка великих рандомизованих контролисаних испитивања. Фаза 3 студије (INHALE) објављене 2020. године такође није дала позитивне резултате (инхалација амикацина потпомогнутих интравенских антибиотика за грам-негативну бактеријску инфекцију изазвану ВАП пацијентима, двоструко слепо, рандомизовано, плацебо контролисано испитивање ефикасности фазе 3, укупно 807 пацијената, системски лекови + потпомогнута инхалација амикацина током 10 дана).
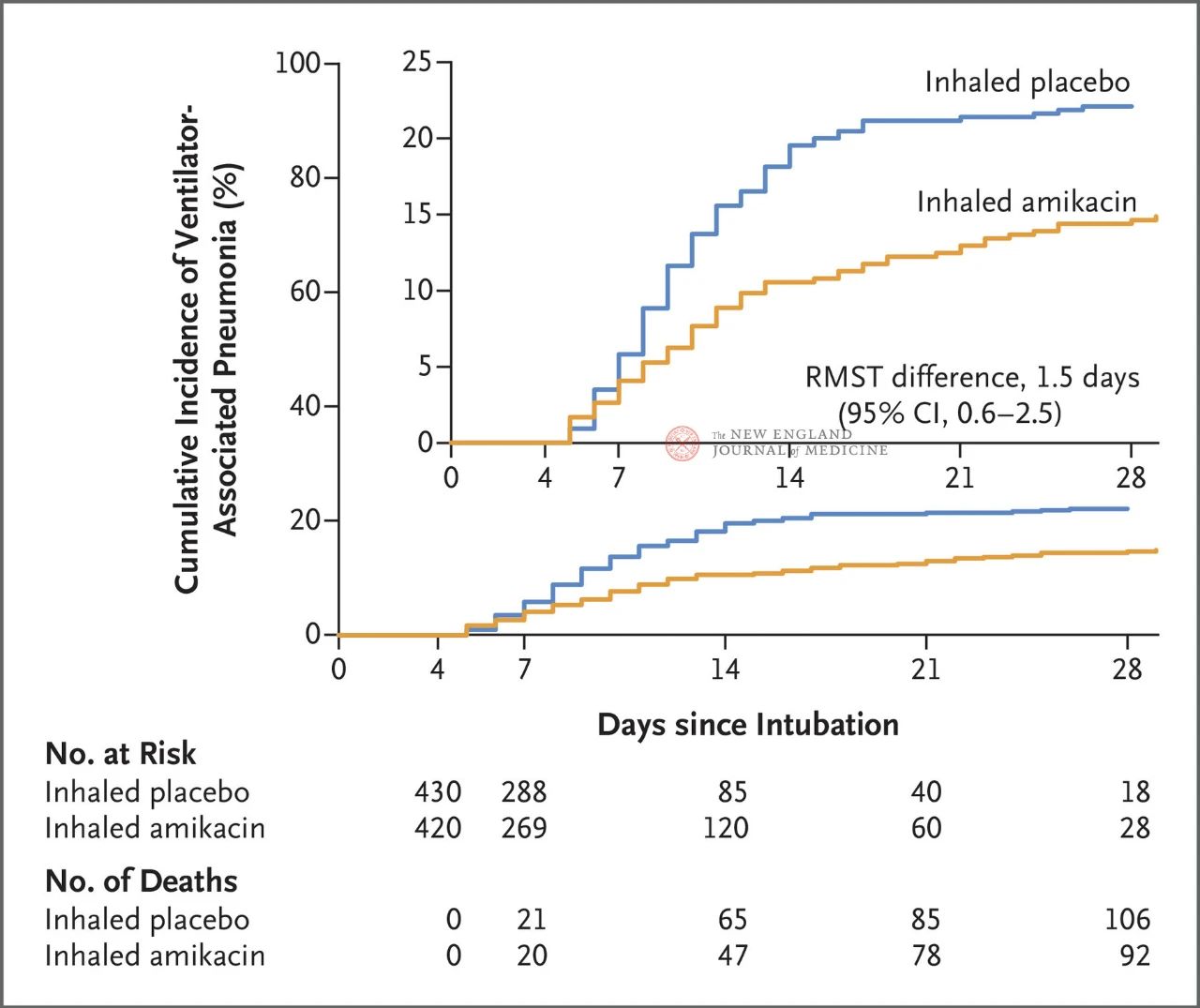
У овом контексту, тим који су предводили истраживачи из Регионалног универзитетског болничког центра у Туру (CHRU) у Француској усвојио је другачију истраживачку стратегију и спровео мултицентрично, двоструко слепо, рандомизовано контролисано испитивање ефикасности (AMIKINHAL) које је покренуо истраживач. Инхалирани амикацин или плацебо за превенцију вентилаторске асистивне инфекције (ВАП) упоређени су у 19 јединица интензивне неге у Француској [13].
Укупно 847 одраслих пацијената са инвазивном механичком вентилацијом између 72 и 96 сати је насумично распоређено у односу 1:1 у групу која је примала инхалацију амикацина (N= 417,20 мг/кг идеалне телесне тежине, QD) или инхалацију плацеба (N=430, 0,9% еквивалент натријум хлорида) током 3 дана. Примарни крајњи циљ била је прва епизода вентилације вентилацијом од почетка рандомизованог распоређивања до 28. дана.
Резултати испитивања су показали да је након 28 дана 62 пацијента (15%) у групи која је примала амикацин развило вентилаторну апнеју (ВАП), а 95 пацијената (22%) у групи која је примала плацебо развило је ВАП (ограничена просечна разлика у преживљавању за ВАП била је 1,5 дана; 95% CI, 0,6~2,5; P=0,004).
Што се тиче безбедности, седам пацијената (1,7%) у групи која је примала амикацин и четири пацијента (0,9%) у групи која је примала плацебо искусило је озбиљне нежељене догађаје повезане са испитивањем. Међу онима који нису имали акутно оштећење бубрега приликом рандомизације, 11 пацијената (4%) у групи која је примала амикацин и 24 пацијента (8%) у групи која је примала плацебо имало је акутно оштећење бубрега 28. дана (HR, 0,47; 95% CI, 0,23~0,96).
Клиничко испитивање је имало три главна аспекта. Прво, у погледу дизајна студије, испитивање AMIKINHAL се ослања на IASIS испитивање (рандомизовано, двоструко слепо, плацебо контролисано, паралелно испитивање фазе 2 које је обухватило 143 пацијента). Да би се проценила безбедност и ефикасност инхалације амикацина-фосфомицина за системски третман грам-негативне бактеријске инфекције изазване вентилационо-акумулираном инфекцијом (ВАП) и INHALE испитивање које се завршило негативним резултатима, фокусирало се на превенцију ВАП-а и добило релативно добре резултате. Због карактеристика високе смртности и дугог боравка у болници код пацијената са механичком вентилацијом и ВАП-ом, ако инхалација амикацина може постићи значајно различите резултате у смањењу смртности и боравка у болници код ових пацијената, биће вреднија за клиничку праксу. Међутим, с обзиром на хетерогеност касног лечења и неге код сваког пацијента и сваког центра, постоји низ збуњујућих фактора који могу ометати студију, тако да може бити тешко добити позитиван резултат који се може приписати инхалираним антибиотицима. Стога, успешна клиничка студија захтева не само одличан дизајн студије, већ и избор одговарајућих примарних крајњих тачака.
Друго, иако се аминогликозидни антибиотици не препоручују као појединачни лек у различитим смерницама за вентилаторску инфекцију (ВАП), аминогликозидни антибиотици могу покрити уобичајене патогене код ВАП пацијената (укључујући псеудомонас аеругиноса, ацинетобактер, итд.), и због њихове ограничене апсорпције у ћелијама плућног епитела, високе концентрације на месту инфекције и ниске системске токсичности. Аминогликозидни антибиотици су широко фаворизовани међу инхалационим антибиотицима. Овај рад је у складу са свеобухватном проценом величине ефекта интратрахеалне примене гентамицина у малим узорцима објављеним раније, што заједно показује ефекат инхалационих аминогликозидних антибиотика у спречавању ВАП-а. Такође треба напоменути да је већина плацебо контрола одабраних у испитивањима везаним за инхалационе антибиотике физиолошки раствор. Међутим, с обзиром на то да атомизована инхалација самог физиолошког раствора може играти одређену улогу у разблаживању спутума и помагању експекторансу, физиолошки раствор може изазвати одређене сметње у анализи резултата студије, што треба свеобухватно размотрити у студији.
Штавише, локална адаптација ХАП/ВАП лекова је важна, као и антибиотска профилакса. Истовремено, без обзира на дужину времена интубације, екологија локалне јединице интензивне неге је најважнији фактор ризика за инфекцију бактеријама отпорним на више лекова. Стога, емпиријски третман треба што више да се позива на микробиолошке податке локалних болница и не може се слепо позивати на смернице или искуство терцијарних болница. Истовремено, критично болесни пацијенти којима је потребна механичка вентилација често су комбиновани са мултисистемским болестима, а под комбинованим деловањем више фактора, као што је стресно стање, може доћи и до феномена преношења цревних микроба у плућа. Висока хетерогеност болести узрокованих унутрашњом и спољашњом суперпозицијом такође одређује да је клиничка промоција сваке нове интервенције на великој скали дуг пут.
Време објаве: 02.12.2023.