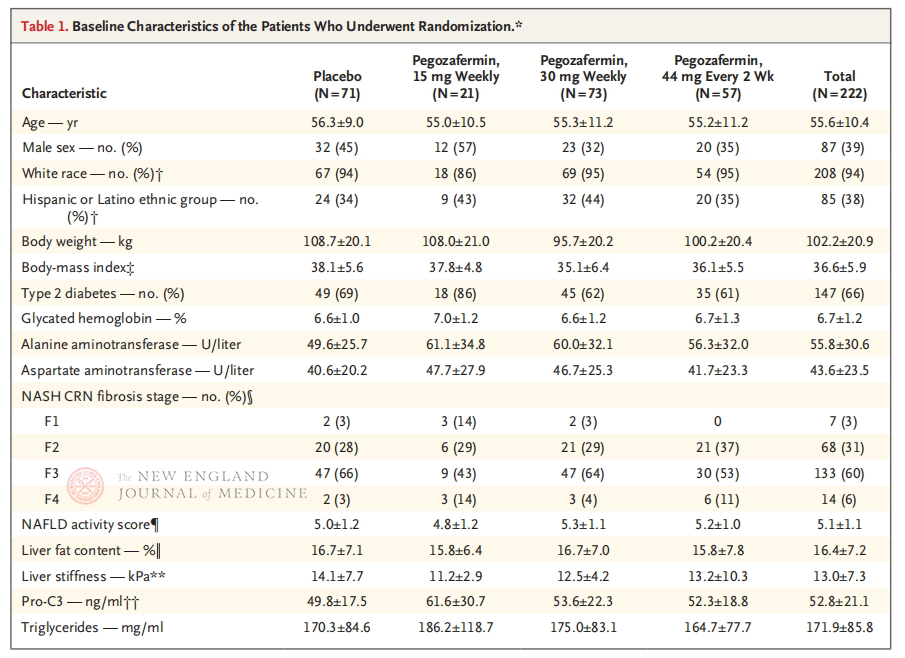
Данас је неалкохолна масна болест јетре (НАФБЈ) постала главни узрок хроничне болести јетре у Кини, па чак и у свету. Спектар болести укључује једноставан хепатични стеатохепатитис, неалкохолни стеатохепатитис (НАСХ) и повезану цирозу и рак јетре. НАСХ карактерише прекомерно накупљање масти у хепатоцитима и индуковано оштећење ћелија и упала, са или без хепатичне фиброзе. Тежина фиброзе јетре код пацијената са НАСХ је уско повезана са лошом прогнозом јетре (цироза и њене компликације и хепатоцелуларни карцином), кардиоваскуларним догађајима, екстрахепатичним малигнитетима и смрћу од свих узрока. НАСХ може негативно утицати на квалитет живота пацијената; међутим, ниједан лек или терапија нису одобрени за лечење НАСХ.
Недавна студија (ENLIVEN) објављена у часопису New England Journal of Medicine (NEJM) показала је да пегозафермин побољшава и фиброзу јетре и упалу јетре код пацијената са NASH без циротичне киселине, потврђене биопсијом.
Мултицентрично, рандомизовано, двоструко слепо, плацебо контролисано клиничко испитивање фазе 2б, које су спровели професор Рохит Лумба и његов клинички тим на Медицинском факултету Универзитета у Калифорнији, у Сан Дијегу, обухватило је 222 пацијента са биопсијом потврђеним НАСХ стадијума Ф2-3 између 28. септембра 2021. и 15. августа 2022. године. Пацијенти су насумично распоређени у групе које су примале пегозафермин (субкутана ињекција, 15 мг или 30 мг једном недељно, или 44 мг једном сваке 2 недеље) или плацебо (једном недељно или једном сваке 2 недеље). Примарни крајњи циљеви укључивали су побољшање фиброзе ≥ 1. стадијума и одсуство прогресије НАСХ. НАСХ се повукао без фиброзне прогресије. Студија је такође спровела процену безбедности.
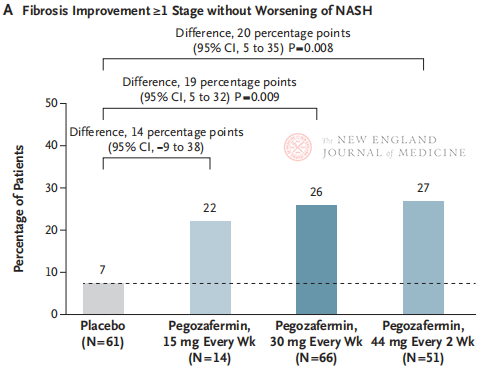
Након 24 недеље лечења, удео пацијената са побољшањем фиброзе ≥ стадијума 1 и без погоршања НАСХ-а, и удео пацијената са регресијом НАСХ-а и без погоршања фиброзе били су значајно већи у три групе које су примале пегозафермин него у плацебо групи, са значајнијим разликама код пацијената лечених са 44 мг једном у две недеље или 30 мг једном недељно. Што се тиче безбедности, пегозафермин је био сличан плацебу. Најчешћи нежељени ефекти повезани са лечењем пегозафермином били су мучнина, дијареја и еритем на месту ињекције. У овом испитивању фазе 2б, прелиминарни резултати указују на то да лечење пегозафермином побољшава фиброзу јетре.
Пегозафермин, коришћен у овој студији, је дугоделујући гликоловани аналог људског фактора раста фибробласта 21 (FGF21). FGF21 је ендогени метаболички хормон који лучи јетра, а који игра улогу у регулацији метаболизма липида и глукозе. Претходне студије су показале да FGF21 има терапеутске ефекте на пацијенте са NASH повећавањем осетљивости јетре на инсулин, стимулисањем оксидације масних киселина и инхибирањем липогенезе. Међутим, кратко време полураспада природног FGF21 (око 2 сата) ограничава његову употребу у клиничком лечењу NASH. Пегозафермин користи технологију гликозилисане пегилације како би продужио време полураспада природног FGF21 и оптимизовао његову биолошку активност.
Поред позитивних резултата у овом клиничком испитивању фазе 2б, још једна недавно објављена студија у часопису Nature Medicine (ENTRIGUE) показала је да пегозафермин такође значајно смањује триглицериде, не-ХДЛ холестерол, аполипопротеин Б и хепатичну стеатозу код пацијената са тешком хипертриглицеридемијом, што може имати позитиван утицај на смањење ризика од кардиоваскуларних догађаја код пацијената са НАСХ.
Ове студије указују да пегозафермин, као ендогени метаболички хормон, може пружити вишеструке метаболичке користи пацијентима са НАСХ, посебно зато што би НАСХ у будућности могао бити преименован у метаболички повезану масну болест јетре. Ови резултати га чине веома важним потенцијалним леком за лечење НАСХ. Истовремено, ови позитивни резултати студије ће подржати увођење пегозафермина у клиничка испитивања фазе 3.
Иако је и двонедељни третман пегозафермином од 44 мг или недељни третман пегозафермином од 30 мг постигао хистолошки примарни крајњи циљ испитивања, трајање лечења у овој студији је било само 24 недеље, а стопа усаглашености у плацебо групи је била само 7%, што је значајно ниже од резултата претходних клиничких студија које су трајале 48 недеља. Да ли су разлике и безбедност исте? С обзиром на хетерогеност НАСХ, у будућности су потребна већа, мултицентрична, међународна клиничка испитивања како би се обухватиле веће популације пацијената и продужило трајање лечења како би се боље проценила ефикасност и безбедност лека.
Време објаве: 16. септембар 2023.